
암세포와 혈관 간의 상호작용을 실제 인체 환경처럼 정밀하게 모사하고 실시간으로 분석할 수 있는 칩 기술이 개발됐다. 이를 통해 ‘환자 맞춤형 항암제 개발’ 기술이 한층 더 정교해졌다. UNIST 바이오메디컬공학과 조윤경 교수 연구팀은 암세포와 혈관 사이의 상호작용을 대량으로 실시간 분석할 수 있는 미세 유체 칩 '오디세이(ODSEI) 칩'을 개발했다고 밝혔다.
암세포와 혈관세포의 상호작용
암세포의 본질은 ‘비정상적인 성장’이다. 정상세포가 일정한 횟수만 분열한 뒤 더 이상 분열할 수 없는 것과 달리, 암세포는 무제한으로 성장·분열할 수 있고 그 성장 속도도 빠르다. 세포 사멸(아폽토시스)을 회피하는 능력이 있어, 손상을 입더라도 계속 생존하면서 분열을 거듭한다.
암세포는 ‘비정상적으로 빠른 성장’을 위해 매우 빠른 대사 속도를 발휘한다. 그 결과 정상세포에 비해 영양분과 에너지를 빠르게 소모하게 되고, 그만큼 더 많은 영양분과 산소를 가져다 쓰려 한다. 다만, 외부에서 공급되는 자원에는 한계가 있고, 암세포가 이를 스스로 만들 수도 없다. 그리하여 암세포는 주변의 혈관세포를 자극해 필요한 자원을 끌어온다.
이는 암과 혈관 사이의 상호작용을 이해해야 하는 이유가 된다. 암세포와 혈관세포 사이의 상호작용을 명확하게 파악함으로써, 암세포의 변화무쌍한 전이, 약물 내성 메커니즘을 알게 되는 것은 물론, 효과적 치료 전략을 세우고 맞춤형 항암제를 개발하는 데도 도움이 되기 위해서다.
인체 미세환경 본뜬 개방형 시스템
보통 종양 미세환경을 연구할 때는 동물 모델을 사용한다. 이를 통해 종양의 성장 및 전이 과정을 상당 부분 이해할 수 있었지만, 본질적으로 인간과는 미세한 환경이 다르기 때문에 한계가 있었다. 이를 보완하기 위해 ‘3차원 종양 스페로이드 배양 시스템’이 개발됐고, 종양의 입체적 구조를 표현할 수 있었다. 다만, 기존 시스템들은 대개 폐쇄형 구조로 돼 있어, 세포를 선택적으로 회수하거나 유연하게 조작하는 것이 어려웠다.
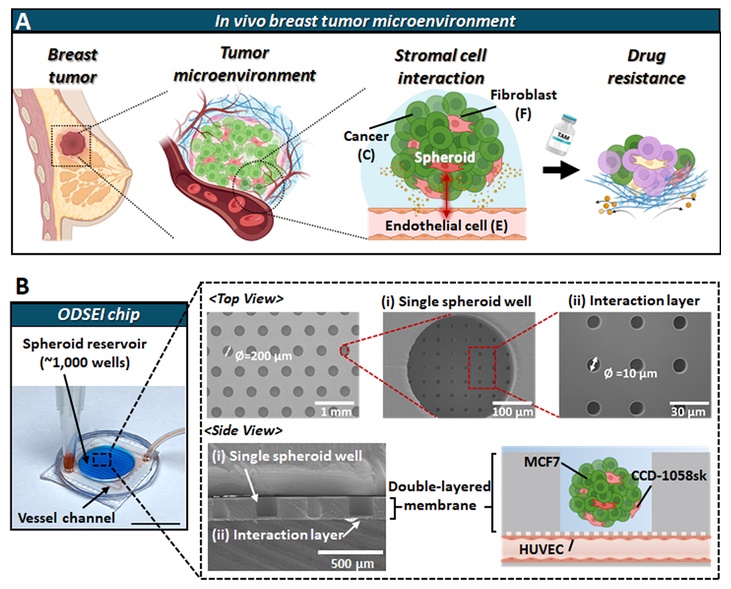
UNIST 연구팀은 이러한 문제점을 해결할 수 있는 방법을 고민했으며, 그 결과 암세포와 혈관세포 사이의 상호작용을 분석하기 위해 실제 인체 환경을 정밀하게 본떠 분석할 수 있는 칩을 개발하는 데 성공했다. 연구팀이 개발한 ODSEI 칩은 1,000개 이상의 암 덩어리(종양 스페로이드)를 혈관세포와 함께 배양해 분석할 수 있는 장치다.
또한, ODSEI 칩은 기존의 폐쇄형 시스템과 달리, 개방형 구조로 설계돼 있다. 이로써 특정 시점에 원하는 스페로이드만 회수해 유전자 분석을 할 수 있다. 이를 통해 암세포가 혈관과 상호작용하며 내성을 획득하는 경과를 정밀하게 추적할 수 있다.
맞춤형 항암제 개발을 위한 자료 제공 가능
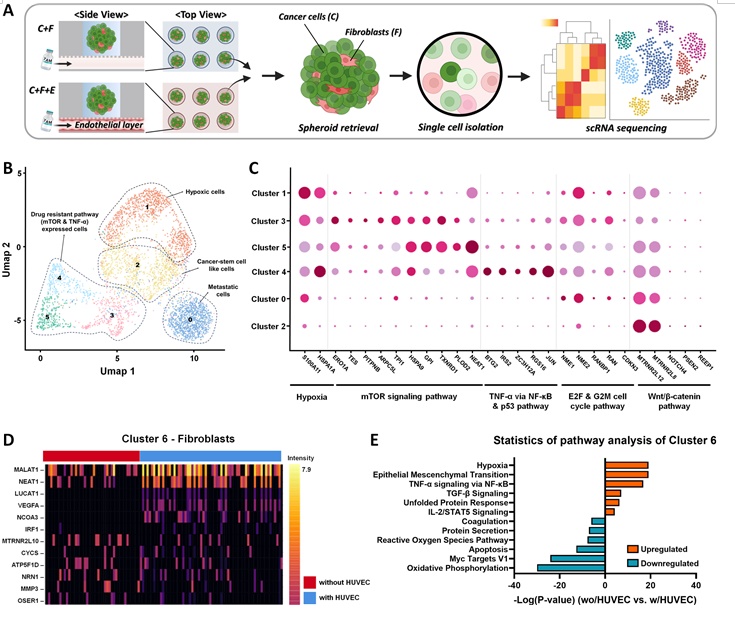
연구팀은 ODSEI 칩을 활용해 기존 유방암 치료제인 ‘타목시펜’에 대해 암세포가 내성을 갖게 되는 과정을 연구했다. 먼저 단일 세포 RNA 시퀀싱과 단백질 분석을 통해 혈관 약물 전달 효율을 높일 수 있는 바이오마커인 IL-8, TIMP-1을 발굴했다.
또한, 이 신호 물질들이 암세포의 생존 신호를 활성화하고 치료제에 대한 반응을 억제함으로써 암세포가 약물 내성을 보이는 과정을 규명했다. 이는 내성 획득 여부와 그 과정을 토대로 맞춤형 항암제를 개발하는 데 중요한 기초 자료를 제공해줄 수 있다.
이번 연구에 제1저자로 참여한 노주영 학생은 “칩은 특수 코팅된 이중층 다공성막으로 설계돼 개방형 구조를 가지면서도 실제 인체와 유사한 환경을 모사할 수 있다”고 설명했다.
암세포와 혈관 세포는 물리적으로는 분리돼 있지만, 신호 물질은 자유롭게 오갈 수 있어 영향을 주고받을 수 있는 구조다. 또한 각 암세포 스페로이드는 개별 웰(well)에 분리돼 배양되므로, 간섭 없이 스페로이드 단위로 독립적인 관찰과 분석이 가능하다.
조윤경 교수는 “종양 미세환경을 정교하게 모사한 조건에서 약물 내성을 효과적으로 연구할 수 있는 길이 열렸다”며 “이 기술은 환자 맞춤형 치료법 개발을 위한 중요한 플랫폼이 될 것”이라고 기대했다.
이번 연구는 기초과학연구원(IBS)과 보건복지부의 지원을 받아 수행됐으며, 연구 결과는 국제 학술지 <어드밴스드 사이언스(Advanced Science)>에 지난 4월 3일 출판됐다. 이번 권두 표지논문으로 선정됐으며, 미세 유체칩 분야 핫 토픽(hot topic)에도 올랐다.
논문 제목은 ‘ODSEI 칩: 종양 구형체-내피세포 상호작용 연구를 위한 개방형 3D 미세 유체 플랫폼(ODSEI Chip: An Open 3D Microfluidic Platform for Studying Tumor Spheroid‐Endothelial Interactions)’이다.
-
부작용 없는 대장암 치료제, ‘먹는 약’ 형태로 개발돼
기존 항암제는 몸 전체로 퍼져 정상 세포에도 영향을 미치는 부작용이 있었다. 부산대학교에서 개발한 '먹는 대장암 약물'은 대장암 부위에만 선택적으로 전달되도록 설계됐다. -
아주대병원, 치료 어려운 두경부암 ‘실마리’ 찾았다
아주대병원 이비인후과 연구팀이 난치성 암 중 하나로 알려진 두경부암에 대한 새로운 연구 결과를 발표했다. 암세포의 생존을 돕는 단백질을 규명해, 새로운 치료 가능성을 제시했다. -
췌장암 치료, 항체 기반 표적 치료 개발 중
췌장암 생존율은 보통 15% 내외로 매우 낮다. 덴마크 코펜하겐 대학 연구팀이 췌장암을 표적 치료할 수 있는 항체 기반 치료법을 발표했다. -
박테리아로 암 치료, 독성 없는 미생물 활용한 중증 암 치료법
박테리아로 암을 치료하는 방법이 임상시험을 앞두고 있다. 주사를 맞고 3일 뒤 아스피린만 복용하면 되는 간단한 방법이라 주목받을 만하다. -
항암제 안 듣는 췌장암 세포, 적외선으로 잡았다
항암제에 내성을 갖게 된 췌장암 세포, 광 반응 화합물과 적외선으로 사멸 가능. 항암제 안 듣는 난치암 치료에 기여할 것으로 기대. -
면역항암제 효능 확대, 혈액암 넘어 고형암까지
항암치료를 방해하는 ‘나쁜 세포’만 정밀하게 제거할 수 있는 약물이 개발됐다. 이로써 고형암 치료에도 효과를 기대할 수 있는 면역항암제 개발 가능성이 생겼다. -
바이러스 치료제+상처 회복까지, 천연 다기능 펩타이드 개발
티모신 β4는 대부분의 세포 내에 널리 분포하는 펩타이드다. KIST 연구팀은 이 펩타이드가 분해되면서 생성되는 대사체가 항바이러스 기능과 조직 재생 기능을 동시에 갖추고 있음을 발견했다. -
암 성장 예측, 환자 특성에 따라 더욱 정밀하게
국내 연구진이 인공 암 조직 성장 기술의 새로운 패러다임을 제시했다. 실제 인체와 유사한 종양미세환경을 구현함으로써, 암 성장 예측의 정확도를 한층 더 끌어올리는 데 성공했다. -
암세포 성장과 비만의 연결고리, 호르몬 아닌 ‘지방산 산화’
국립암센터 연구팀이 암세포가 직접 지방산을 산화시키며 폭발적으로 성장한다는 점을 세계 최초로 증명해냈다. 호르몬 변화에 영향을 받는다는 기존 이론과 다른 견해를 입증한 것이다.

